Российское общество онкоурологов (РООУ): Носов А.К. РМП
11.05.2021

Носов Александр Константинович
к.м.н., доцент, член Правления РООУ, старший научный сотрудник, заведующий хирургическим отделением онкоурологии и общей онкологии ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава Р Ф, г. Санкт-Петербург
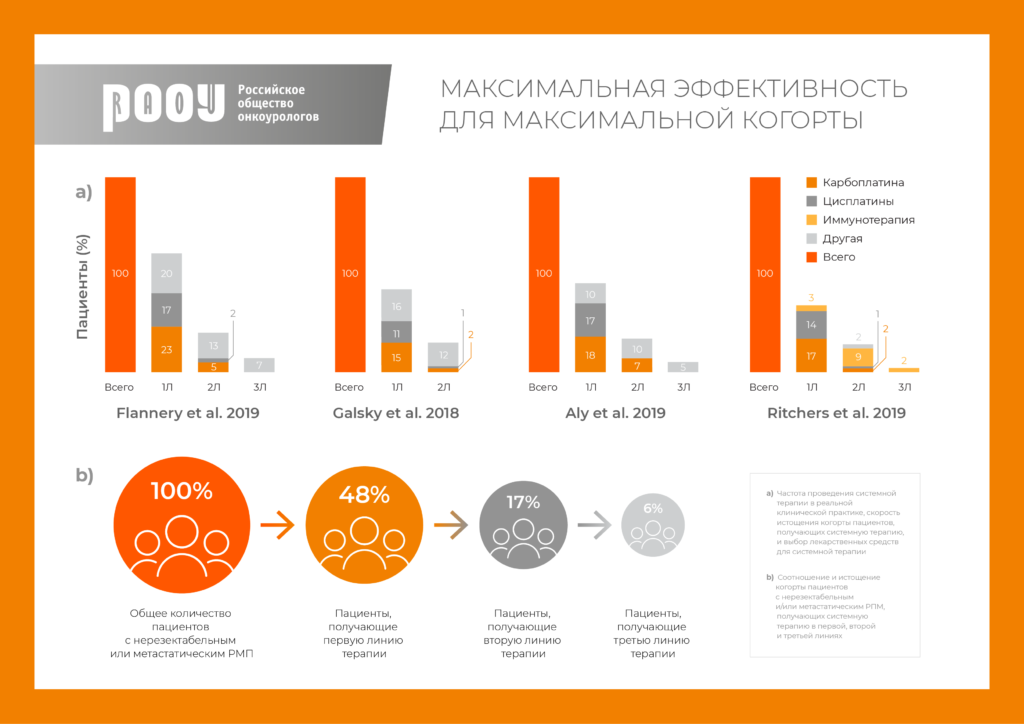
Максимальный ответ в максимальной когорте
Использование иммунотерапии одновременно с химиотерапией или сразу после нее позволило достичь максимума по частоте и длительности ответа, а также расширило когорту пациентов, которые получают не только химиотерапию. О глобальном истощении популяции пациентов с метастатическим уротелиальным раком и обновленных рекомендациях международных сообществ – в экспертном мнении специально для РООУ.
. . .
С 2021 года EAU и NCCN внесли правки в текущие рекомендации по лечению нерезектабельного и (или) метастатического уротелиального рака. Одна из них – немедленное применение ингибитора иммунных контрольных точек авелумаба у всех пациентов, демонстрирующих стабилизацию или ответ после 4–6 курсов химиотерапии, основанной на цисплатине или карбоплатине. Настоящее решение принято на основании результатов исследования Javelin Bladder 100, опубликованного в 2020 году в NEJM [1] и обновленного в 2021 году во время ASCO-GU.
Необходимо отметить, что практически одновременно были опубликованы и данные исследования ImVigor-130 – первого позитивного исследования по применению химиотерапии в сочетании с ингибитором иммунных контрольных точек атезолизумабом [2]. По мнению А. К. Носова, применение иммунотерапии именно в комбинации с химиотерапией, а не сразу после нее, может давать дополнительные преимущества: «В протоколе ImVigor-130 мы видим двукратное увеличение числа полных ответов, в связи с чем возможно предположить, что назначение иммунотерапии на стадии инициации химиотерапии может давать дополнительные преимущества», – отметил он.
«Однако в настоящее время в отношении атезолизумаба позиции различных профессиональных сообществ расходятся, что связано прежде всего с накоплением необходимых статистических данных», – отмечает А. К. Носов.
Пока что в международных и отечественных рекомендациях атезолизумаб сохраняет свое положение в качестве препарата монотерапии, предназначенного для лечения при прогрессировании заболевания на фоне платиносодержащей ХТ (прогрессирование на 1-й линии) и в течение 12 месяцев после неоадъювантной или адъювантной ХТ. Как и пембролизумаб, он может быть применен в 1-й линии терапии у пациентов с высоким уровнем экспрессии PD‐L1, не подходящих для цисплатинсодержащей терапии.
Как отметил проф. Б. Я. Алексеев на одной из школ РООУ, схема, подразумевающая одновременное применение химиотерапии и атезолизумаба, зарегистрирована в МЗ РФ и в настоящее время проходит соответствующая работа по ее включению в отечественные рекомендации.
Поддерживающая терапия
В течение последних пяти десятилетий схема лечения метастатического и (или) нерезектабельного уротелиального рака оставалась неизменной, основанной на платиносодержащих схемах. «К сожалению, мы знаем, что достигаемые в 50–60 % объективные ответы при использовании подобных схем химиотерапии скоротечны, в первый год прогрессирование происходит у большинства больных, почти у 70 %», – отмечает А. К. Носов.
Учитывая отмеченные эффекты иммунотерапии, использованной сразу после завершения курса химиотерапии, научное сообщество пришло к выводу: чтобы начать лечение ингибиторами иммунных контрольных точек, ждать прогрессии не надо. Согласно обновленным рекомендациям, лечение должно быть назначено незамедлительно – после нивелирования токсических проявлений проведенной химиотерапии. Данная рекомендация обоснована результатами Javelin Bladder 100, объединившего 700 пациентов. После успешного завершения курса химиотерапии пациенты были рандомизированы в две группы – получающие авелумаб или просто надлежащий уход (best supportive care).
Общая выживаемость через 1 год составила 71,3 % в группе авелумаба и 58,4 % в контрольной группе (медиана общей выживаемости 21,4 месяца по сравнению с 14,3 месяца). Авелумаб также значительно продлил общую выживаемость в PD-L1-положительной популяции: общая выживаемость через 1 год составила 79,1 % в группе авелумаба и 60,4 % в контрольной группе.
«Это исследование – входной билет для применения авелумаба на более ранней стадии, как и в принципе для смещения иммунотерапии на более приоритетные позиции», – считает А. К. Носов.
Дело в том, что все ингибиторы иммунных контрольных точек показаны для применения во второй линии терапии (после прогрессирования) и в 1-й линии у пациентов с высокой экспрессией PD-L1, не подходящих для платиносодержащей терапии. Пембролизумаб также одобрен для лечения карциномы in situ, РМП, рефрактерного к бацилле Кальмета – Герена, а также для пациентов, не подходящих для радикальной цистэктомии или не желающих подвергнуться ей.
«Однако частота объективного ответа при назначении терапии ингибиторами иммунных контрольных точек в среднем колеблется от 20 до 23 %, что в два раза ниже, чем при химиотерапии с применением цисплатина, – отмечает А. К. Носов. – Но при этом пациенты, ответившие на применение иммунотерапии, имеют очень продолжительное сохранение достигнутого эффекта, много превышающее по длительности ответ после применения химиотерапии».
Таким образом, отмечает А. К. Носов, объединение двух лекарственных модальностей – это возможность максимально увеличить эффективность лечения у максимального количества пациентов. «До сегодняшнего дня химиотерапия демонстрирует максимальное число ответов, как частичных, так и полных, а иммунотерапия обеспечивает высокую продолжительность достигнутых эффектов, – подчеркивает А. К. Носов. – Объединение двух вариантов лечения – это удачная и однозначно востребованная идея, позволяющая достигнуть потенцирования двух лекарственных направлений: с одной стороны, мы достигаем наибольшего числа объективных ответов, а с другой – поддерживаем их максимально долго».
А. К. Носов отмечает, что комбинированный подход позволяет реализовать максимально эффективную первую линию терапии, что чрезвычайно важно, так как возможности назначения второй линии у большинства больных метастатическим уротелиальным раком нет.
Как отметил в текущем году на ASCO-GU ведущий мировой эксперт в области иммунотерапии T. Powles, абсолютное большинство пациентов просто не успевают получить вторую линию терапии в силу экстремально быстрой прогрессии заболевания и значительно ухудшающегося функционального статуса: «Когорта больных, получающих вторую линию терапии, истощается примерно втрое», – отметил он.
По мнению T. Powles, применение иммунотерапии в поддерживающем режиме, то есть сразу после завершения химиотерапии, позволит максимально расширить популяцию больных, которые смогут пройти эффективное лечение с сохранением достойного качества жизни.
На настоящий момент идея поддерживающей терапии ингибиторами иммунных контрольных точек при уротелиальном раке также реализуется для пациентов, перенесших цистэктомию. Так, в текущем году на ASCO-GU были продемонстрированы результаты применения ниволумаба в адъювантном режиме: медиана выживаемости без прогрессирования составила 21 месяц в группе пациентов, получавших ниволумаб, и 11 месяцев в группе плацебо.
«Мы также принимали участие в настоящем протоколе, и хотя эти результаты еще не отразились на рекомендациях и пока опубликованы лишь в качестве доклада на ASCO-GU, они являются еще одним аргументом в пользу как можно более раннего назначения ингибиторов иммунных контрольных точек при уротелиальном раке», – отметил А. К. Носов.
Без химии?
Учитывая новые данные, возможно ли предположить полное исчезновение химиотерапии из схем лечения уротелиального рака? А. К. Носов считает, что в ближайшее время обойтись без химиотерапии невозможно: «Первое, о чем думает врач, разрабатывая тактику лечения пациента с метастатическим или неоперабельным уротелиальным раком, – о возможности назначить химиотерапию; более того, мы должны стремиться провести терапию, основанную на цисплатине, – говорит эксперт. – И только пациенты, неспособные перенести химиотерапевтическое лечение, в первой линии получают лечение ингибиторами иммунных контрольных точек».
А. К. Носов подчеркивает, что, как и во всем мире, в России существует проблема недоиспользования химиотерапии и глобальный тренд в сторону предпочтения карбоплатины. «Зачастую применение карбоплатины обосновано не реальными показаниями, а желанием доктора оставаться в зоне комфорта», – считает А. К. Носов.
Интересно, что аналогичный тренд продемонстрирован в европейских и американских популяционных исследованиях: не менее одной трети пациентов, подходящих для применения химиотерапии на основе цисплатина, получают карбоплатин – достоверно менее эффективный режим.
В исследованиях реальной клинической практики США также выявлена выраженная диспропорция среди пациентов, требующих лечения и получающих его: недостаточное использование системной терапии в целом и непропорционально высокая частота применения химиотерапии на основе карбоплатина [3].
«В этом контексте надо максимально жестко добиться соблюдения протоколов лечения всех категорий больных уротелиальным раком и достичь такой ситуации, когда не менее половины пациентов будут получать цисплатин, то есть тот препарат, который демонстрирует наибольшую эффективность в отношении этой категории пациентов, – отмечает А. К. Носов. – Дополнение терапии цисплатином ингибиторами иммунных контрольных точек даст дополнительные преимущества. Но начать надо с того, чтобы пациенты просто могли получить химиотерапию, основанную на цисплатине».
Согласно Umang Swamo, стратегия увеличения доли пациентов, получающих системную терапию в первой и последующих линиях, предполагает:
Увеличение доступности в мировой литературе описывается двумя схожими по переводу, но абсолютно разными по значению словами – affordability и accessibility. Под affordability дословно понимается финансовая доступность лекарственных средств (cheap enough for ordinary people to afford), под accessibility – логистическая (easy for anyone to obtain and use).
«Нельзя не отметить, что, как бы мы ни ругали эти КСГ и прочие схемы, а все же доступность современного лечения в двух отмеченных аспектах увеличилась, – подчеркивает А. К. Носов. – Наравне с требованиями по доступности мы должны проявлять жесткие требования по соблюдению стандартов лечения и обеспечению пациентам сохранного статуса, позволяющего проводить системную терапию».
Бежать, чтобы оставаться на месте
«Обновленные рекомендации по сочетанию возможностей химиотерапии и иммунотерапии – это действительно новая парадигма терапии нерезектабельного или метастатического уротелиального рака. Но мы должны рассматривать ее не как будущее и даже не как настоящее в лечении пациентов с уротелиальным раком, – подчеркивает А. К. Носов. – Эти современные схемы должны максимально быстро становиться рутинными.
Эксперт подчеркивает, что современное поколение врачей стало свидетелем невероятно стремительного развития фармакологии: новые опции лечения устаревают быстрее, чем успеют стать рутинными. «Уже сейчас завершены исследования, продемонстрировавшие более высокую эффективность новых препаратов, в частности – энфортумаб ведотина, – отмечает А. К. Носов. – Однако чрезвычайно высокая стоимость делает современные лекарственные подходы недоступными для абсолютного числа национальных систем здравоохранения.
Как заявляется в мировой прессе, упомянутый препарат (энфортумаб ведотина) не входит в широкую практику исключительно из-за высокой стоимости. Так, согласно заявлению производителя, стоимость курса лечения им составит 110–120 тысяч долларов [5]. «Так или иначе, то, что сегодня считается новым и прорывным, в итоге устареет, – и мы должны стремиться к тому, чтобы новые и эффективные подходы использовались рутинно уже сейчас».
. . .
В статье упомянуты следующие данные:
. . .
Носов А К.
Ссылка на источник - Российское общество онкоурологов (РООУ).
к.м.н., доцент, член Правления РООУ, старший научный сотрудник, заведующий хирургическим отделением онкоурологии и общей онкологии ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава Р Ф, г. Санкт-Петербург
Максимальный ответ в максимальной когорте
Использование иммунотерапии одновременно с химиотерапией или сразу после нее позволило достичь максимума по частоте и длительности ответа, а также расширило когорту пациентов, которые получают не только химиотерапию. О глобальном истощении популяции пациентов с метастатическим уротелиальным раком и обновленных рекомендациях международных сообществ – в экспертном мнении специально для РООУ.
. . .
С 2021 года EAU и NCCN внесли правки в текущие рекомендации по лечению нерезектабельного и (или) метастатического уротелиального рака. Одна из них – немедленное применение ингибитора иммунных контрольных точек авелумаба у всех пациентов, демонстрирующих стабилизацию или ответ после 4–6 курсов химиотерапии, основанной на цисплатине или карбоплатине. Настоящее решение принято на основании результатов исследования Javelin Bladder 100, опубликованного в 2020 году в NEJM [1] и обновленного в 2021 году во время ASCO-GU.
Необходимо отметить, что практически одновременно были опубликованы и данные исследования ImVigor-130 – первого позитивного исследования по применению химиотерапии в сочетании с ингибитором иммунных контрольных точек атезолизумабом [2]. По мнению А. К. Носова, применение иммунотерапии именно в комбинации с химиотерапией, а не сразу после нее, может давать дополнительные преимущества: «В протоколе ImVigor-130 мы видим двукратное увеличение числа полных ответов, в связи с чем возможно предположить, что назначение иммунотерапии на стадии инициации химиотерапии может давать дополнительные преимущества», – отметил он.
«Однако в настоящее время в отношении атезолизумаба позиции различных профессиональных сообществ расходятся, что связано прежде всего с накоплением необходимых статистических данных», – отмечает А. К. Носов.
Пока что в международных и отечественных рекомендациях атезолизумаб сохраняет свое положение в качестве препарата монотерапии, предназначенного для лечения при прогрессировании заболевания на фоне платиносодержащей ХТ (прогрессирование на 1-й линии) и в течение 12 месяцев после неоадъювантной или адъювантной ХТ. Как и пембролизумаб, он может быть применен в 1-й линии терапии у пациентов с высоким уровнем экспрессии PD‐L1, не подходящих для цисплатинсодержащей терапии.
Как отметил проф. Б. Я. Алексеев на одной из школ РООУ, схема, подразумевающая одновременное применение химиотерапии и атезолизумаба, зарегистрирована в МЗ РФ и в настоящее время проходит соответствующая работа по ее включению в отечественные рекомендации.
Поддерживающая терапия
В течение последних пяти десятилетий схема лечения метастатического и (или) нерезектабельного уротелиального рака оставалась неизменной, основанной на платиносодержащих схемах. «К сожалению, мы знаем, что достигаемые в 50–60 % объективные ответы при использовании подобных схем химиотерапии скоротечны, в первый год прогрессирование происходит у большинства больных, почти у 70 %», – отмечает А. К. Носов.
Учитывая отмеченные эффекты иммунотерапии, использованной сразу после завершения курса химиотерапии, научное сообщество пришло к выводу: чтобы начать лечение ингибиторами иммунных контрольных точек, ждать прогрессии не надо. Согласно обновленным рекомендациям, лечение должно быть назначено незамедлительно – после нивелирования токсических проявлений проведенной химиотерапии. Данная рекомендация обоснована результатами Javelin Bladder 100, объединившего 700 пациентов. После успешного завершения курса химиотерапии пациенты были рандомизированы в две группы – получающие авелумаб или просто надлежащий уход (best supportive care).
Общая выживаемость через 1 год составила 71,3 % в группе авелумаба и 58,4 % в контрольной группе (медиана общей выживаемости 21,4 месяца по сравнению с 14,3 месяца). Авелумаб также значительно продлил общую выживаемость в PD-L1-положительной популяции: общая выживаемость через 1 год составила 79,1 % в группе авелумаба и 60,4 % в контрольной группе.
«Это исследование – входной билет для применения авелумаба на более ранней стадии, как и в принципе для смещения иммунотерапии на более приоритетные позиции», – считает А. К. Носов.
Дело в том, что все ингибиторы иммунных контрольных точек показаны для применения во второй линии терапии (после прогрессирования) и в 1-й линии у пациентов с высокой экспрессией PD-L1, не подходящих для платиносодержащей терапии. Пембролизумаб также одобрен для лечения карциномы in situ, РМП, рефрактерного к бацилле Кальмета – Герена, а также для пациентов, не подходящих для радикальной цистэктомии или не желающих подвергнуться ей.
«Однако частота объективного ответа при назначении терапии ингибиторами иммунных контрольных точек в среднем колеблется от 20 до 23 %, что в два раза ниже, чем при химиотерапии с применением цисплатина, – отмечает А. К. Носов. – Но при этом пациенты, ответившие на применение иммунотерапии, имеют очень продолжительное сохранение достигнутого эффекта, много превышающее по длительности ответ после применения химиотерапии».
Таким образом, отмечает А. К. Носов, объединение двух лекарственных модальностей – это возможность максимально увеличить эффективность лечения у максимального количества пациентов. «До сегодняшнего дня химиотерапия демонстрирует максимальное число ответов, как частичных, так и полных, а иммунотерапия обеспечивает высокую продолжительность достигнутых эффектов, – подчеркивает А. К. Носов. – Объединение двух вариантов лечения – это удачная и однозначно востребованная идея, позволяющая достигнуть потенцирования двух лекарственных направлений: с одной стороны, мы достигаем наибольшего числа объективных ответов, а с другой – поддерживаем их максимально долго».
А. К. Носов отмечает, что комбинированный подход позволяет реализовать максимально эффективную первую линию терапии, что чрезвычайно важно, так как возможности назначения второй линии у большинства больных метастатическим уротелиальным раком нет.
Как отметил в текущем году на ASCO-GU ведущий мировой эксперт в области иммунотерапии T. Powles, абсолютное большинство пациентов просто не успевают получить вторую линию терапии в силу экстремально быстрой прогрессии заболевания и значительно ухудшающегося функционального статуса: «Когорта больных, получающих вторую линию терапии, истощается примерно втрое», – отметил он.
По мнению T. Powles, применение иммунотерапии в поддерживающем режиме, то есть сразу после завершения химиотерапии, позволит максимально расширить популяцию больных, которые смогут пройти эффективное лечение с сохранением достойного качества жизни.
На настоящий момент идея поддерживающей терапии ингибиторами иммунных контрольных точек при уротелиальном раке также реализуется для пациентов, перенесших цистэктомию. Так, в текущем году на ASCO-GU были продемонстрированы результаты применения ниволумаба в адъювантном режиме: медиана выживаемости без прогрессирования составила 21 месяц в группе пациентов, получавших ниволумаб, и 11 месяцев в группе плацебо.
«Мы также принимали участие в настоящем протоколе, и хотя эти результаты еще не отразились на рекомендациях и пока опубликованы лишь в качестве доклада на ASCO-GU, они являются еще одним аргументом в пользу как можно более раннего назначения ингибиторов иммунных контрольных точек при уротелиальном раке», – отметил А. К. Носов.
Без химии?
Учитывая новые данные, возможно ли предположить полное исчезновение химиотерапии из схем лечения уротелиального рака? А. К. Носов считает, что в ближайшее время обойтись без химиотерапии невозможно: «Первое, о чем думает врач, разрабатывая тактику лечения пациента с метастатическим или неоперабельным уротелиальным раком, – о возможности назначить химиотерапию; более того, мы должны стремиться провести терапию, основанную на цисплатине, – говорит эксперт. – И только пациенты, неспособные перенести химиотерапевтическое лечение, в первой линии получают лечение ингибиторами иммунных контрольных точек».
А. К. Носов подчеркивает, что, как и во всем мире, в России существует проблема недоиспользования химиотерапии и глобальный тренд в сторону предпочтения карбоплатины. «Зачастую применение карбоплатины обосновано не реальными показаниями, а желанием доктора оставаться в зоне комфорта», – считает А. К. Носов.
Интересно, что аналогичный тренд продемонстрирован в европейских и американских популяционных исследованиях: не менее одной трети пациентов, подходящих для применения химиотерапии на основе цисплатина, получают карбоплатин – достоверно менее эффективный режим.
В исследованиях реальной клинической практики США также выявлена выраженная диспропорция среди пациентов, требующих лечения и получающих его: недостаточное использование системной терапии в целом и непропорционально высокая частота применения химиотерапии на основе карбоплатина [3].
«В этом контексте надо максимально жестко добиться соблюдения протоколов лечения всех категорий больных уротелиальным раком и достичь такой ситуации, когда не менее половины пациентов будут получать цисплатин, то есть тот препарат, который демонстрирует наибольшую эффективность в отношении этой категории пациентов, – отмечает А. К. Носов. – Дополнение терапии цисплатином ингибиторами иммунных контрольных точек даст дополнительные преимущества. Но начать надо с того, чтобы пациенты просто могли получить химиотерапию, основанную на цисплатине».
Согласно Umang Swamo, стратегия увеличения доли пациентов, получающих системную терапию в первой и последующих линиях, предполагает:
- увеличение финансовой и логистической доступности системного лечения (affordability и accessibility);
- стандартизацию и улучшение качества помощи пациентам с локализованными формами РМП с целью улучшения сохранности их функционального статуса и возможности дальнейшего назначения системной терапии;
- отсрочку и снижение частоты прогрессирования локализованных форм уротелиального рака за счет улучшения использования неоадъювантной химиотерапии на основе цисплатина и разработки более эффективных схем неоадъювантной и (или) адъювантной терапии с применением новейших лекарственных средств;
- введение в реальную клиническую практику поддерживающей терапии с применением авелумаба после ответа или стабилизации заболевания на фоне 4–6 циклов химиотерапии на основе платины с целью минимизации отсева пациентов для получения терапии ингибиторами иммунных контрольных точек;
- внедрение в реальную клиническую практику эффективных и хорошо переносимых схем системной терапии, таких как комбинация энфортумаб ведотин с ингибиторами PD-1/L1 (или без них) в первой линии терапии.
Увеличение доступности в мировой литературе описывается двумя схожими по переводу, но абсолютно разными по значению словами – affordability и accessibility. Под affordability дословно понимается финансовая доступность лекарственных средств (cheap enough for ordinary people to afford), под accessibility – логистическая (easy for anyone to obtain and use).
«Нельзя не отметить, что, как бы мы ни ругали эти КСГ и прочие схемы, а все же доступность современного лечения в двух отмеченных аспектах увеличилась, – подчеркивает А. К. Носов. – Наравне с требованиями по доступности мы должны проявлять жесткие требования по соблюдению стандартов лечения и обеспечению пациентам сохранного статуса, позволяющего проводить системную терапию».
Бежать, чтобы оставаться на месте
«Обновленные рекомендации по сочетанию возможностей химиотерапии и иммунотерапии – это действительно новая парадигма терапии нерезектабельного или метастатического уротелиального рака. Но мы должны рассматривать ее не как будущее и даже не как настоящее в лечении пациентов с уротелиальным раком, – подчеркивает А. К. Носов. – Эти современные схемы должны максимально быстро становиться рутинными.
Эксперт подчеркивает, что современное поколение врачей стало свидетелем невероятно стремительного развития фармакологии: новые опции лечения устаревают быстрее, чем успеют стать рутинными. «Уже сейчас завершены исследования, продемонстрировавшие более высокую эффективность новых препаратов, в частности – энфортумаб ведотина, – отмечает А. К. Носов. – Однако чрезвычайно высокая стоимость делает современные лекарственные подходы недоступными для абсолютного числа национальных систем здравоохранения.
Как заявляется в мировой прессе, упомянутый препарат (энфортумаб ведотина) не входит в широкую практику исключительно из-за высокой стоимости. Так, согласно заявлению производителя, стоимость курса лечения им составит 110–120 тысяч долларов [5]. «Так или иначе, то, что сегодня считается новым и прорывным, в итоге устареет, – и мы должны стремиться к тому, чтобы новые и эффективные подходы использовались рутинно уже сейчас».
. . .
В статье упомянуты следующие данные:
- T. Powles et al., Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma // NEJM, 2020.
- M.Galsky et al., Atezolizumab with or without chemotherapy in metastatic urothelial cancer (IMvigor130): a multicentre, randomised, placebo-controlled phase 3 trial // The Lancet, 2020.
- Richters, A., et al., Utilization of systemic treatment for metastatic bladder cancer in everyday practice: results of a nation-wide population-based cohort study. Cancer Treatment Res. Commun., 2020.
- Umang Swami et al., Utilization of systemic therapy for treatment of advanced urothelial carcinoma: Lessons from real world experience // Cancer treatment and research communication, 2021.
- https://www.bioworld.com/articles/431921-fda-grants-accelerated-approval-for-padcev-to-treat-urothelial-cancer.
. . .
Носов А К.
Ссылка на источник - Российское общество онкоурологов (РООУ).
Носов Александр Константинович
к.м.н., доцент, член Правления РООУ, старший научный сотрудник, заведующий хирургическим отделением онкоурологии и общей онкологии ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава Р Ф, г. Санкт-Петербург
Максимальный ответ в максимальной когорте
Использование иммунотерапии одновременно с химиотерапией или сразу после нее позволило достичь максимума по частоте и длительности ответа, а также расширило когорту пациентов, которые получают не только химиотерапию. О глобальном истощении популяции пациентов с метастатическим уротелиальным раком и обновленных рекомендациях международных сообществ – в экспертном мнении специально для РООУ.
. . .
С 2021 года EAU и NCCN внесли правки в текущие рекомендации по лечению нерезектабельного и (или) метастатического уротелиального рака. Одна из них – немедленное применение ингибитора иммунных контрольных точек авелумаба у всех пациентов, демонстрирующих стабилизацию или ответ после 4–6 курсов химиотерапии, основанной на цисплатине или карбоплатине. Настоящее решение принято на основании результатов исследования Javelin Bladder 100, опубликованного в 2020 году в NEJM [1] и обновленного в 2021 году во время ASCO-GU.
Необходимо отметить, что практически одновременно были опубликованы и данные исследования ImVigor-130 – первого позитивного исследования по применению химиотерапии в сочетании с ингибитором иммунных контрольных точек атезолизумабом [2]. По мнению А. К. Носова, применение иммунотерапии именно в комбинации с химиотерапией, а не сразу после нее, может давать дополнительные преимущества: «В протоколе ImVigor-130 мы видим двукратное увеличение числа полных ответов, в связи с чем возможно предположить, что назначение иммунотерапии на стадии инициации химиотерапии может давать дополнительные преимущества», – отметил он.
«Однако в настоящее время в отношении атезолизумаба позиции различных профессиональных сообществ расходятся, что связано прежде всего с накоплением необходимых статистических данных», – отмечает А. К. Носов.
Пока что в международных и отечественных рекомендациях атезолизумаб сохраняет свое положение в качестве препарата монотерапии, предназначенного для лечения при прогрессировании заболевания на фоне платиносодержащей ХТ (прогрессирование на 1-й линии) и в течение 12 месяцев после неоадъювантной или адъювантной ХТ. Как и пембролизумаб, он может быть применен в 1-й линии терапии у пациентов с высоким уровнем экспрессии PD‐L1, не подходящих для цисплатинсодержащей терапии.
Как отметил проф. Б. Я. Алексеев на одной из школ РООУ, схема, подразумевающая одновременное применение химиотерапии и атезолизумаба, зарегистрирована в МЗ РФ и в настоящее время проходит соответствующая работа по ее включению в отечественные рекомендации.
Поддерживающая терапия
В течение последних пяти десятилетий схема лечения метастатического и (или) нерезектабельного уротелиального рака оставалась неизменной, основанной на платиносодержащих схемах. «К сожалению, мы знаем, что достигаемые в 50–60 % объективные ответы при использовании подобных схем химиотерапии скоротечны, в первый год прогрессирование происходит у большинства больных, почти у 70 %», – отмечает А. К. Носов.
Учитывая отмеченные эффекты иммунотерапии, использованной сразу после завершения курса химиотерапии, научное сообщество пришло к выводу: чтобы начать лечение ингибиторами иммунных контрольных точек, ждать прогрессии не надо. Согласно обновленным рекомендациям, лечение должно быть назначено незамедлительно – после нивелирования токсических проявлений проведенной химиотерапии. Данная рекомендация обоснована результатами Javelin Bladder 100, объединившего 700 пациентов. После успешного завершения курса химиотерапии пациенты были рандомизированы в две группы – получающие авелумаб или просто надлежащий уход (best supportive care).
Общая выживаемость через 1 год составила 71,3 % в группе авелумаба и 58,4 % в контрольной группе (медиана общей выживаемости 21,4 месяца по сравнению с 14,3 месяца). Авелумаб также значительно продлил общую выживаемость в PD-L1-положительной популяции: общая выживаемость через 1 год составила 79,1 % в группе авелумаба и 60,4 % в контрольной группе.
«Это исследование – входной билет для применения авелумаба на более ранней стадии, как и в принципе для смещения иммунотерапии на более приоритетные позиции», – считает А. К. Носов.
Дело в том, что все ингибиторы иммунных контрольных точек показаны для применения во второй линии терапии (после прогрессирования) и в 1-й линии у пациентов с высокой экспрессией PD-L1, не подходящих для платиносодержащей терапии. Пембролизумаб также одобрен для лечения карциномы in situ, РМП, рефрактерного к бацилле Кальмета – Герена, а также для пациентов, не подходящих для радикальной цистэктомии или не желающих подвергнуться ей.
«Однако частота объективного ответа при назначении терапии ингибиторами иммунных контрольных точек в среднем колеблется от 20 до 23 %, что в два раза ниже, чем при химиотерапии с применением цисплатина, – отмечает А. К. Носов. – Но при этом пациенты, ответившие на применение иммунотерапии, имеют очень продолжительное сохранение достигнутого эффекта, много превышающее по длительности ответ после применения химиотерапии».
Таким образом, отмечает А. К. Носов, объединение двух лекарственных модальностей – это возможность максимально увеличить эффективность лечения у максимального количества пациентов. «До сегодняшнего дня химиотерапия демонстрирует максимальное число ответов, как частичных, так и полных, а иммунотерапия обеспечивает высокую продолжительность достигнутых эффектов, – подчеркивает А. К. Носов. – Объединение двух вариантов лечения – это удачная и однозначно востребованная идея, позволяющая достигнуть потенцирования двух лекарственных направлений: с одной стороны, мы достигаем наибольшего числа объективных ответов, а с другой – поддерживаем их максимально долго».
А. К. Носов отмечает, что комбинированный подход позволяет реализовать максимально эффективную первую линию терапии, что чрезвычайно важно, так как возможности назначения второй линии у большинства больных метастатическим уротелиальным раком нет.
Как отметил в текущем году на ASCO-GU ведущий мировой эксперт в области иммунотерапии T. Powles, абсолютное большинство пациентов просто не успевают получить вторую линию терапии в силу экстремально быстрой прогрессии заболевания и значительно ухудшающегося функционального статуса: «Когорта больных, получающих вторую линию терапии, истощается примерно втрое», – отметил он.
По мнению T. Powles, применение иммунотерапии в поддерживающем режиме, то есть сразу после завершения химиотерапии, позволит максимально расширить популяцию больных, которые смогут пройти эффективное лечение с сохранением достойного качества жизни.
На настоящий момент идея поддерживающей терапии ингибиторами иммунных контрольных точек при уротелиальном раке также реализуется для пациентов, перенесших цистэктомию. Так, в текущем году на ASCO-GU были продемонстрированы результаты применения ниволумаба в адъювантном режиме: медиана выживаемости без прогрессирования составила 21 месяц в группе пациентов, получавших ниволумаб, и 11 месяцев в группе плацебо.
«Мы также принимали участие в настоящем протоколе, и хотя эти результаты еще не отразились на рекомендациях и пока опубликованы лишь в качестве доклада на ASCO-GU, они являются еще одним аргументом в пользу как можно более раннего назначения ингибиторов иммунных контрольных точек при уротелиальном раке», – отметил А. К. Носов.
Без химии?
Учитывая новые данные, возможно ли предположить полное исчезновение химиотерапии из схем лечения уротелиального рака? А. К. Носов считает, что в ближайшее время обойтись без химиотерапии невозможно: «Первое, о чем думает врач, разрабатывая тактику лечения пациента с метастатическим или неоперабельным уротелиальным раком, – о возможности назначить химиотерапию; более того, мы должны стремиться провести терапию, основанную на цисплатине, – говорит эксперт. – И только пациенты, неспособные перенести химиотерапевтическое лечение, в первой линии получают лечение ингибиторами иммунных контрольных точек».
А. К. Носов подчеркивает, что, как и во всем мире, в России существует проблема недоиспользования химиотерапии и глобальный тренд в сторону предпочтения карбоплатины. «Зачастую применение карбоплатины обосновано не реальными показаниями, а желанием доктора оставаться в зоне комфорта», – считает А. К. Носов.
Интересно, что аналогичный тренд продемонстрирован в европейских и американских популяционных исследованиях: не менее одной трети пациентов, подходящих для применения химиотерапии на основе цисплатина, получают карбоплатин – достоверно менее эффективный режим.
В исследованиях реальной клинической практики США также выявлена выраженная диспропорция среди пациентов, требующих лечения и получающих его: недостаточное использование системной терапии в целом и непропорционально высокая частота применения химиотерапии на основе карбоплатина [3].
«В этом контексте надо максимально жестко добиться соблюдения протоколов лечения всех категорий больных уротелиальным раком и достичь такой ситуации, когда не менее половины пациентов будут получать цисплатин, то есть тот препарат, который демонстрирует наибольшую эффективность в отношении этой категории пациентов, – отмечает А. К. Носов. – Дополнение терапии цисплатином ингибиторами иммунных контрольных точек даст дополнительные преимущества. Но начать надо с того, чтобы пациенты просто могли получить химиотерапию, основанную на цисплатине».
Согласно Umang Swamo, стратегия увеличения доли пациентов, получающих системную терапию в первой и последующих линиях, предполагает:
Увеличение доступности в мировой литературе описывается двумя схожими по переводу, но абсолютно разными по значению словами – affordability и accessibility. Под affordability дословно понимается финансовая доступность лекарственных средств (cheap enough for ordinary people to afford), под accessibility – логистическая (easy for anyone to obtain and use).
«Нельзя не отметить, что, как бы мы ни ругали эти КСГ и прочие схемы, а все же доступность современного лечения в двух отмеченных аспектах увеличилась, – подчеркивает А. К. Носов. – Наравне с требованиями по доступности мы должны проявлять жесткие требования по соблюдению стандартов лечения и обеспечению пациентам сохранного статуса, позволяющего проводить системную терапию».
Бежать, чтобы оставаться на месте
«Обновленные рекомендации по сочетанию возможностей химиотерапии и иммунотерапии – это действительно новая парадигма терапии нерезектабельного или метастатического уротелиального рака. Но мы должны рассматривать ее не как будущее и даже не как настоящее в лечении пациентов с уротелиальным раком, – подчеркивает А. К. Носов. – Эти современные схемы должны максимально быстро становиться рутинными.
Эксперт подчеркивает, что современное поколение врачей стало свидетелем невероятно стремительного развития фармакологии: новые опции лечения устаревают быстрее, чем успеют стать рутинными. «Уже сейчас завершены исследования, продемонстрировавшие более высокую эффективность новых препаратов, в частности – энфортумаб ведотина, – отмечает А. К. Носов. – Однако чрезвычайно высокая стоимость делает современные лекарственные подходы недоступными для абсолютного числа национальных систем здравоохранения.
Как заявляется в мировой прессе, упомянутый препарат (энфортумаб ведотина) не входит в широкую практику исключительно из-за высокой стоимости. Так, согласно заявлению производителя, стоимость курса лечения им составит 110–120 тысяч долларов [5]. «Так или иначе, то, что сегодня считается новым и прорывным, в итоге устареет, – и мы должны стремиться к тому, чтобы новые и эффективные подходы использовались рутинно уже сейчас».
. . .
В статье упомянуты следующие данные:
. . .
Носов А К.
Ссылка на источник - Российское общество онкоурологов (РООУ).
к.м.н., доцент, член Правления РООУ, старший научный сотрудник, заведующий хирургическим отделением онкоурологии и общей онкологии ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава Р Ф, г. Санкт-Петербург
Максимальный ответ в максимальной когорте
Использование иммунотерапии одновременно с химиотерапией или сразу после нее позволило достичь максимума по частоте и длительности ответа, а также расширило когорту пациентов, которые получают не только химиотерапию. О глобальном истощении популяции пациентов с метастатическим уротелиальным раком и обновленных рекомендациях международных сообществ – в экспертном мнении специально для РООУ.
. . .
С 2021 года EAU и NCCN внесли правки в текущие рекомендации по лечению нерезектабельного и (или) метастатического уротелиального рака. Одна из них – немедленное применение ингибитора иммунных контрольных точек авелумаба у всех пациентов, демонстрирующих стабилизацию или ответ после 4–6 курсов химиотерапии, основанной на цисплатине или карбоплатине. Настоящее решение принято на основании результатов исследования Javelin Bladder 100, опубликованного в 2020 году в NEJM [1] и обновленного в 2021 году во время ASCO-GU.
Необходимо отметить, что практически одновременно были опубликованы и данные исследования ImVigor-130 – первого позитивного исследования по применению химиотерапии в сочетании с ингибитором иммунных контрольных точек атезолизумабом [2]. По мнению А. К. Носова, применение иммунотерапии именно в комбинации с химиотерапией, а не сразу после нее, может давать дополнительные преимущества: «В протоколе ImVigor-130 мы видим двукратное увеличение числа полных ответов, в связи с чем возможно предположить, что назначение иммунотерапии на стадии инициации химиотерапии может давать дополнительные преимущества», – отметил он.
«Однако в настоящее время в отношении атезолизумаба позиции различных профессиональных сообществ расходятся, что связано прежде всего с накоплением необходимых статистических данных», – отмечает А. К. Носов.
Пока что в международных и отечественных рекомендациях атезолизумаб сохраняет свое положение в качестве препарата монотерапии, предназначенного для лечения при прогрессировании заболевания на фоне платиносодержащей ХТ (прогрессирование на 1-й линии) и в течение 12 месяцев после неоадъювантной или адъювантной ХТ. Как и пембролизумаб, он может быть применен в 1-й линии терапии у пациентов с высоким уровнем экспрессии PD‐L1, не подходящих для цисплатинсодержащей терапии.
Как отметил проф. Б. Я. Алексеев на одной из школ РООУ, схема, подразумевающая одновременное применение химиотерапии и атезолизумаба, зарегистрирована в МЗ РФ и в настоящее время проходит соответствующая работа по ее включению в отечественные рекомендации.
Поддерживающая терапия
В течение последних пяти десятилетий схема лечения метастатического и (или) нерезектабельного уротелиального рака оставалась неизменной, основанной на платиносодержащих схемах. «К сожалению, мы знаем, что достигаемые в 50–60 % объективные ответы при использовании подобных схем химиотерапии скоротечны, в первый год прогрессирование происходит у большинства больных, почти у 70 %», – отмечает А. К. Носов.
Учитывая отмеченные эффекты иммунотерапии, использованной сразу после завершения курса химиотерапии, научное сообщество пришло к выводу: чтобы начать лечение ингибиторами иммунных контрольных точек, ждать прогрессии не надо. Согласно обновленным рекомендациям, лечение должно быть назначено незамедлительно – после нивелирования токсических проявлений проведенной химиотерапии. Данная рекомендация обоснована результатами Javelin Bladder 100, объединившего 700 пациентов. После успешного завершения курса химиотерапии пациенты были рандомизированы в две группы – получающие авелумаб или просто надлежащий уход (best supportive care).
Общая выживаемость через 1 год составила 71,3 % в группе авелумаба и 58,4 % в контрольной группе (медиана общей выживаемости 21,4 месяца по сравнению с 14,3 месяца). Авелумаб также значительно продлил общую выживаемость в PD-L1-положительной популяции: общая выживаемость через 1 год составила 79,1 % в группе авелумаба и 60,4 % в контрольной группе.
«Это исследование – входной билет для применения авелумаба на более ранней стадии, как и в принципе для смещения иммунотерапии на более приоритетные позиции», – считает А. К. Носов.
Дело в том, что все ингибиторы иммунных контрольных точек показаны для применения во второй линии терапии (после прогрессирования) и в 1-й линии у пациентов с высокой экспрессией PD-L1, не подходящих для платиносодержащей терапии. Пембролизумаб также одобрен для лечения карциномы in situ, РМП, рефрактерного к бацилле Кальмета – Герена, а также для пациентов, не подходящих для радикальной цистэктомии или не желающих подвергнуться ей.
«Однако частота объективного ответа при назначении терапии ингибиторами иммунных контрольных точек в среднем колеблется от 20 до 23 %, что в два раза ниже, чем при химиотерапии с применением цисплатина, – отмечает А. К. Носов. – Но при этом пациенты, ответившие на применение иммунотерапии, имеют очень продолжительное сохранение достигнутого эффекта, много превышающее по длительности ответ после применения химиотерапии».
Таким образом, отмечает А. К. Носов, объединение двух лекарственных модальностей – это возможность максимально увеличить эффективность лечения у максимального количества пациентов. «До сегодняшнего дня химиотерапия демонстрирует максимальное число ответов, как частичных, так и полных, а иммунотерапия обеспечивает высокую продолжительность достигнутых эффектов, – подчеркивает А. К. Носов. – Объединение двух вариантов лечения – это удачная и однозначно востребованная идея, позволяющая достигнуть потенцирования двух лекарственных направлений: с одной стороны, мы достигаем наибольшего числа объективных ответов, а с другой – поддерживаем их максимально долго».
А. К. Носов отмечает, что комбинированный подход позволяет реализовать максимально эффективную первую линию терапии, что чрезвычайно важно, так как возможности назначения второй линии у большинства больных метастатическим уротелиальным раком нет.
Как отметил в текущем году на ASCO-GU ведущий мировой эксперт в области иммунотерапии T. Powles, абсолютное большинство пациентов просто не успевают получить вторую линию терапии в силу экстремально быстрой прогрессии заболевания и значительно ухудшающегося функционального статуса: «Когорта больных, получающих вторую линию терапии, истощается примерно втрое», – отметил он.
По мнению T. Powles, применение иммунотерапии в поддерживающем режиме, то есть сразу после завершения химиотерапии, позволит максимально расширить популяцию больных, которые смогут пройти эффективное лечение с сохранением достойного качества жизни.
На настоящий момент идея поддерживающей терапии ингибиторами иммунных контрольных точек при уротелиальном раке также реализуется для пациентов, перенесших цистэктомию. Так, в текущем году на ASCO-GU были продемонстрированы результаты применения ниволумаба в адъювантном режиме: медиана выживаемости без прогрессирования составила 21 месяц в группе пациентов, получавших ниволумаб, и 11 месяцев в группе плацебо.
«Мы также принимали участие в настоящем протоколе, и хотя эти результаты еще не отразились на рекомендациях и пока опубликованы лишь в качестве доклада на ASCO-GU, они являются еще одним аргументом в пользу как можно более раннего назначения ингибиторов иммунных контрольных точек при уротелиальном раке», – отметил А. К. Носов.
Без химии?
Учитывая новые данные, возможно ли предположить полное исчезновение химиотерапии из схем лечения уротелиального рака? А. К. Носов считает, что в ближайшее время обойтись без химиотерапии невозможно: «Первое, о чем думает врач, разрабатывая тактику лечения пациента с метастатическим или неоперабельным уротелиальным раком, – о возможности назначить химиотерапию; более того, мы должны стремиться провести терапию, основанную на цисплатине, – говорит эксперт. – И только пациенты, неспособные перенести химиотерапевтическое лечение, в первой линии получают лечение ингибиторами иммунных контрольных точек».
А. К. Носов подчеркивает, что, как и во всем мире, в России существует проблема недоиспользования химиотерапии и глобальный тренд в сторону предпочтения карбоплатины. «Зачастую применение карбоплатины обосновано не реальными показаниями, а желанием доктора оставаться в зоне комфорта», – считает А. К. Носов.
Интересно, что аналогичный тренд продемонстрирован в европейских и американских популяционных исследованиях: не менее одной трети пациентов, подходящих для применения химиотерапии на основе цисплатина, получают карбоплатин – достоверно менее эффективный режим.
В исследованиях реальной клинической практики США также выявлена выраженная диспропорция среди пациентов, требующих лечения и получающих его: недостаточное использование системной терапии в целом и непропорционально высокая частота применения химиотерапии на основе карбоплатина [3].
«В этом контексте надо максимально жестко добиться соблюдения протоколов лечения всех категорий больных уротелиальным раком и достичь такой ситуации, когда не менее половины пациентов будут получать цисплатин, то есть тот препарат, который демонстрирует наибольшую эффективность в отношении этой категории пациентов, – отмечает А. К. Носов. – Дополнение терапии цисплатином ингибиторами иммунных контрольных точек даст дополнительные преимущества. Но начать надо с того, чтобы пациенты просто могли получить химиотерапию, основанную на цисплатине».
Согласно Umang Swamo, стратегия увеличения доли пациентов, получающих системную терапию в первой и последующих линиях, предполагает:
- увеличение финансовой и логистической доступности системного лечения (affordability и accessibility);
- стандартизацию и улучшение качества помощи пациентам с локализованными формами РМП с целью улучшения сохранности их функционального статуса и возможности дальнейшего назначения системной терапии;
- отсрочку и снижение частоты прогрессирования локализованных форм уротелиального рака за счет улучшения использования неоадъювантной химиотерапии на основе цисплатина и разработки более эффективных схем неоадъювантной и (или) адъювантной терапии с применением новейших лекарственных средств;
- введение в реальную клиническую практику поддерживающей терапии с применением авелумаба после ответа или стабилизации заболевания на фоне 4–6 циклов химиотерапии на основе платины с целью минимизации отсева пациентов для получения терапии ингибиторами иммунных контрольных точек;
- внедрение в реальную клиническую практику эффективных и хорошо переносимых схем системной терапии, таких как комбинация энфортумаб ведотин с ингибиторами PD-1/L1 (или без них) в первой линии терапии.
Увеличение доступности в мировой литературе описывается двумя схожими по переводу, но абсолютно разными по значению словами – affordability и accessibility. Под affordability дословно понимается финансовая доступность лекарственных средств (cheap enough for ordinary people to afford), под accessibility – логистическая (easy for anyone to obtain and use).
«Нельзя не отметить, что, как бы мы ни ругали эти КСГ и прочие схемы, а все же доступность современного лечения в двух отмеченных аспектах увеличилась, – подчеркивает А. К. Носов. – Наравне с требованиями по доступности мы должны проявлять жесткие требования по соблюдению стандартов лечения и обеспечению пациентам сохранного статуса, позволяющего проводить системную терапию».
Бежать, чтобы оставаться на месте
«Обновленные рекомендации по сочетанию возможностей химиотерапии и иммунотерапии – это действительно новая парадигма терапии нерезектабельного или метастатического уротелиального рака. Но мы должны рассматривать ее не как будущее и даже не как настоящее в лечении пациентов с уротелиальным раком, – подчеркивает А. К. Носов. – Эти современные схемы должны максимально быстро становиться рутинными.
Эксперт подчеркивает, что современное поколение врачей стало свидетелем невероятно стремительного развития фармакологии: новые опции лечения устаревают быстрее, чем успеют стать рутинными. «Уже сейчас завершены исследования, продемонстрировавшие более высокую эффективность новых препаратов, в частности – энфортумаб ведотина, – отмечает А. К. Носов. – Однако чрезвычайно высокая стоимость делает современные лекарственные подходы недоступными для абсолютного числа национальных систем здравоохранения.
Как заявляется в мировой прессе, упомянутый препарат (энфортумаб ведотина) не входит в широкую практику исключительно из-за высокой стоимости. Так, согласно заявлению производителя, стоимость курса лечения им составит 110–120 тысяч долларов [5]. «Так или иначе, то, что сегодня считается новым и прорывным, в итоге устареет, – и мы должны стремиться к тому, чтобы новые и эффективные подходы использовались рутинно уже сейчас».
. . .
В статье упомянуты следующие данные:
- T. Powles et al., Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma // NEJM, 2020.
- M.Galsky et al., Atezolizumab with or without chemotherapy in metastatic urothelial cancer (IMvigor130): a multicentre, randomised, placebo-controlled phase 3 trial // The Lancet, 2020.
- Richters, A., et al., Utilization of systemic treatment for metastatic bladder cancer in everyday practice: results of a nation-wide population-based cohort study. Cancer Treatment Res. Commun., 2020.
- Umang Swami et al., Utilization of systemic therapy for treatment of advanced urothelial carcinoma: Lessons from real world experience // Cancer treatment and research communication, 2021.
- https://www.bioworld.com/ articles/431921-fda-grants- accelerated-approval-for- padcev-to-treat-urothelial-cancer.
. . .
Носов А К.
Ссылка на источник - Российское общество онкоурологов (РООУ).
Носов Александр Константинович
к.м.н., доцент, член Правления РООУ, старший научный сотрудник, заведующий хирургическим отделением онкоурологии и общей онкологии ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава Р Ф, г. Санкт-Петербург
Максимальный ответ в максимальной когорте
Использование иммунотерапии одновременно с химиотерапией или сразу после нее позволило достичь максимума по частоте и длительности ответа, а также расширило когорту пациентов, которые получают не только химиотерапию. О глобальном истощении популяции пациентов с метастатическим уротелиальным раком и обновленных рекомендациях международных сообществ – в экспертном мнении специально для РООУ.
. . .
С 2021 года EAU и NCCN внесли правки в текущие рекомендации по лечению нерезектабельного и (или) метастатического уротелиального рака. Одна из них – немедленное применение ингибитора иммунных контрольных точек авелумаба у всех пациентов, демонстрирующих стабилизацию или ответ после 4–6 курсов химиотерапии, основанной на цисплатине или карбоплатине. Настоящее решение принято на основании результатов исследования Javelin Bladder 100, опубликованного в 2020 году в NEJM [1] и обновленного в 2021 году во время ASCO-GU.
Необходимо отметить, что практически одновременно были опубликованы и данные исследования ImVigor-130 – первого позитивного исследования по применению химиотерапии в сочетании с ингибитором иммунных контрольных точек атезолизумабом [2]. По мнению А. К. Носова, применение иммунотерапии именно в комбинации с химиотерапией, а не сразу после нее, может давать дополнительные преимущества: «В протоколе ImVigor-130 мы видим двукратное увеличение числа полных ответов, в связи с чем возможно предположить, что назначение иммунотерапии на стадии инициации химиотерапии может давать дополнительные преимущества», – отметил он.
«Однако в настоящее время в отношении атезолизумаба позиции различных профессиональных сообществ расходятся, что связано прежде всего с накоплением необходимых статистических данных», – отмечает А. К. Носов.
Пока что в международных и отечественных рекомендациях атезолизумаб сохраняет свое положение в качестве препарата монотерапии, предназначенного для лечения при прогрессировании заболевания на фоне платиносодержащей ХТ (прогрессирование на 1-й линии) и в течение 12 месяцев после неоадъювантной или адъювантной ХТ. Как и пембролизумаб, он может быть применен в 1-й линии терапии у пациентов с высоким уровнем экспрессии PD‐L1, не подходящих для цисплатинсодержащей терапии.
Как отметил проф. Б. Я. Алексеев на одной из школ РООУ, схема, подразумевающая одновременное применение химиотерапии и атезолизумаба, зарегистрирована в МЗ РФ и в настоящее время проходит соответствующая работа по ее включению в отечественные рекомендации.
Поддерживающая терапия
В течение последних пяти десятилетий схема лечения метастатического и (или) нерезектабельного уротелиального рака оставалась неизменной, основанной на платиносодержащих схемах. «К сожалению, мы знаем, что достигаемые в 50–60 % объективные ответы при использовании подобных схем химиотерапии скоротечны, в первый год прогрессирование происходит у большинства больных, почти у 70 %», – отмечает А. К. Носов.
Учитывая отмеченные эффекты иммунотерапии, использованной сразу после завершения курса химиотерапии, научное сообщество пришло к выводу: чтобы начать лечение ингибиторами иммунных контрольных точек, ждать прогрессии не надо. Согласно обновленным рекомендациям, лечение должно быть назначено незамедлительно – после нивелирования токсических проявлений проведенной химиотерапии. Данная рекомендация обоснована результатами Javelin Bladder 100, объединившего 700 пациентов. После успешного завершения курса химиотерапии пациенты были рандомизированы в две группы – получающие авелумаб или просто надлежащий уход (best supportive care).
Общая выживаемость через 1 год составила 71,3 % в группе авелумаба и 58,4 % в контрольной группе (медиана общей выживаемости 21,4 месяца по сравнению с 14,3 месяца). Авелумаб также значительно продлил общую выживаемость в PD-L1-положительной популяции: общая выживаемость через 1 год составила 79,1 % в группе авелумаба и 60,4 % в контрольной группе.
«Это исследование – входной билет для применения авелумаба на более ранней стадии, как и в принципе для смещения иммунотерапии на более приоритетные позиции», – считает А. К. Носов.
Дело в том, что все ингибиторы иммунных контрольных точек показаны для применения во второй линии терапии (после прогрессирования) и в 1-й линии у пациентов с высокой экспрессией PD-L1, не подходящих для платиносодержащей терапии. Пембролизумаб также одобрен для лечения карциномы in situ, РМП, рефрактерного к бацилле Кальмета – Герена, а также для пациентов, не подходящих для радикальной цистэктомии или не желающих подвергнуться ей.
«Однако частота объективного ответа при назначении терапии ингибиторами иммунных контрольных точек в среднем колеблется от 20 до 23 %, что в два раза ниже, чем при химиотерапии с применением цисплатина, – отмечает А. К. Носов. – Но при этом пациенты, ответившие на применение иммунотерапии, имеют очень продолжительное сохранение достигнутого эффекта, много превышающее по длительности ответ после применения химиотерапии».
Таким образом, отмечает А. К. Носов, объединение двух лекарственных модальностей – это возможность максимально увеличить эффективность лечения у максимального количества пациентов. «До сегодняшнего дня химиотерапия демонстрирует максимальное число ответов, как частичных, так и полных, а иммунотерапия обеспечивает высокую продолжительность достигнутых эффектов, – подчеркивает А. К. Носов. – Объединение двух вариантов лечения – это удачная и однозначно востребованная идея, позволяющая достигнуть потенцирования двух лекарственных направлений: с одной стороны, мы достигаем наибольшего числа объективных ответов, а с другой – поддерживаем их максимально долго».
А. К. Носов отмечает, что комбинированный подход позволяет реализовать максимально эффективную первую линию терапии, что чрезвычайно важно, так как возможности назначения второй линии у большинства больных метастатическим уротелиальным раком нет.
Как отметил в текущем году на ASCO-GU ведущий мировой эксперт в области иммунотерапии T. Powles, абсолютное большинство пациентов просто не успевают получить вторую линию терапии в силу экстремально быстрой прогрессии заболевания и значительно ухудшающегося функционального статуса: «Когорта больных, получающих вторую линию терапии, истощается примерно втрое», – отметил он.
По мнению T. Powles, применение иммунотерапии в поддерживающем режиме, то есть сразу после завершения химиотерапии, позволит максимально расширить популяцию больных, которые смогут пройти эффективное лечение с сохранением достойного качества жизни.
На настоящий момент идея поддерживающей терапии ингибиторами иммунных контрольных точек при уротелиальном раке также реализуется для пациентов, перенесших цистэктомию. Так, в текущем году на ASCO-GU были продемонстрированы результаты применения ниволумаба в адъювантном режиме: медиана выживаемости без прогрессирования составила 21 месяц в группе пациентов, получавших ниволумаб, и 11 месяцев в группе плацебо.
«Мы также принимали участие в настоящем протоколе, и хотя эти результаты еще не отразились на рекомендациях и пока опубликованы лишь в качестве доклада на ASCO-GU, они являются еще одним аргументом в пользу как можно более раннего назначения ингибиторов иммунных контрольных точек при уротелиальном раке», – отметил А. К. Носов.
Без химии?
Учитывая новые данные, возможно ли предположить полное исчезновение химиотерапии из схем лечения уротелиального рака? А. К. Носов считает, что в ближайшее время обойтись без химиотерапии невозможно: «Первое, о чем думает врач, разрабатывая тактику лечения пациента с метастатическим или неоперабельным уротелиальным раком, – о возможности назначить химиотерапию; более того, мы должны стремиться провести терапию, основанную на цисплатине, – говорит эксперт. – И только пациенты, неспособные перенести химиотерапевтическое лечение, в первой линии получают лечение ингибиторами иммунных контрольных точек».
А. К. Носов подчеркивает, что, как и во всем мире, в России существует проблема недоиспользования химиотерапии и глобальный тренд в сторону предпочтения карбоплатины. «Зачастую применение карбоплатины обосновано не реальными показаниями, а желанием доктора оставаться в зоне комфорта», – считает А. К. Носов.
Интересно, что аналогичный тренд продемонстрирован в европейских и американских популяционных исследованиях: не менее одной трети пациентов, подходящих для применения химиотерапии на основе цисплатина, получают карбоплатин – достоверно менее эффективный режим.
В исследованиях реальной клинической практики США также выявлена выраженная диспропорция среди пациентов, требующих лечения и получающих его: недостаточное использование системной терапии в целом и непропорционально высокая частота применения химиотерапии на основе карбоплатина [3].
«В этом контексте надо максимально жестко добиться соблюдения протоколов лечения всех категорий больных уротелиальным раком и достичь такой ситуации, когда не менее половины пациентов будут получать цисплатин, то есть тот препарат, который демонстрирует наибольшую эффективность в отношении этой категории пациентов, – отмечает А. К. Носов. – Дополнение терапии цисплатином ингибиторами иммунных контрольных точек даст дополнительные преимущества. Но начать надо с того, чтобы пациенты просто могли получить химиотерапию, основанную на цисплатине».
Согласно Umang Swamo, стратегия увеличения доли пациентов, получающих системную терапию в первой и последующих линиях, предполагает:
Увеличение доступности в мировой литературе описывается двумя схожими по переводу, но абсолютно разными по значению словами – affordability и accessibility. Под affordability дословно понимается финансовая доступность лекарственных средств (cheap enough for ordinary people to afford), под accessibility – логистическая (easy for anyone to obtain and use).
«Нельзя не отметить, что, как бы мы ни ругали эти КСГ и прочие схемы, а все же доступность современного лечения в двух отмеченных аспектах увеличилась, – подчеркивает А. К. Носов. – Наравне с требованиями по доступности мы должны проявлять жесткие требования по соблюдению стандартов лечения и обеспечению пациентам сохранного статуса, позволяющего проводить системную терапию».
Бежать, чтобы оставаться на месте
«Обновленные рекомендации по сочетанию возможностей химиотерапии и иммунотерапии – это действительно новая парадигма терапии нерезектабельного или метастатического уротелиального рака. Но мы должны рассматривать ее не как будущее и даже не как настоящее в лечении пациентов с уротелиальным раком, – подчеркивает А. К. Носов. – Эти современные схемы должны максимально быстро становиться рутинными.
Эксперт подчеркивает, что современное поколение врачей стало свидетелем невероятно стремительного развития фармакологии: новые опции лечения устаревают быстрее, чем успеют стать рутинными. «Уже сейчас завершены исследования, продемонстрировавшие более высокую эффективность новых препаратов, в частности – энфортумаб ведотина, – отмечает А. К. Носов. – Однако чрезвычайно высокая стоимость делает современные лекарственные подходы недоступными для абсолютного числа национальных систем здравоохранения.
Как заявляется в мировой прессе, упомянутый препарат (энфортумаб ведотина) не входит в широкую практику исключительно из-за высокой стоимости. Так, согласно заявлению производителя, стоимость курса лечения им составит 110–120 тысяч долларов [5]. «Так или иначе, то, что сегодня считается новым и прорывным, в итоге устареет, – и мы должны стремиться к тому, чтобы новые и эффективные подходы использовались рутинно уже сейчас».
. . .
В статье упомянуты следующие данные:
. . .
Носов А К.
Ссылка на источник - Российское общество онкоурологов (РООУ).
к.м.н., доцент, член Правления РООУ, старший научный сотрудник, заведующий хирургическим отделением онкоурологии и общей онкологии ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава Р Ф, г. Санкт-Петербург
Максимальный ответ в максимальной когорте
Использование иммунотерапии одновременно с химиотерапией или сразу после нее позволило достичь максимума по частоте и длительности ответа, а также расширило когорту пациентов, которые получают не только химиотерапию. О глобальном истощении популяции пациентов с метастатическим уротелиальным раком и обновленных рекомендациях международных сообществ – в экспертном мнении специально для РООУ.
. . .
С 2021 года EAU и NCCN внесли правки в текущие рекомендации по лечению нерезектабельного и (или) метастатического уротелиального рака. Одна из них – немедленное применение ингибитора иммунных контрольных точек авелумаба у всех пациентов, демонстрирующих стабилизацию или ответ после 4–6 курсов химиотерапии, основанной на цисплатине или карбоплатине. Настоящее решение принято на основании результатов исследования Javelin Bladder 100, опубликованного в 2020 году в NEJM [1] и обновленного в 2021 году во время ASCO-GU.
Необходимо отметить, что практически одновременно были опубликованы и данные исследования ImVigor-130 – первого позитивного исследования по применению химиотерапии в сочетании с ингибитором иммунных контрольных точек атезолизумабом [2]. По мнению А. К. Носова, применение иммунотерапии именно в комбинации с химиотерапией, а не сразу после нее, может давать дополнительные преимущества: «В протоколе ImVigor-130 мы видим двукратное увеличение числа полных ответов, в связи с чем возможно предположить, что назначение иммунотерапии на стадии инициации химиотерапии может давать дополнительные преимущества», – отметил он.
«Однако в настоящее время в отношении атезолизумаба позиции различных профессиональных сообществ расходятся, что связано прежде всего с накоплением необходимых статистических данных», – отмечает А. К. Носов.
Пока что в международных и отечественных рекомендациях атезолизумаб сохраняет свое положение в качестве препарата монотерапии, предназначенного для лечения при прогрессировании заболевания на фоне платиносодержащей ХТ (прогрессирование на 1-й линии) и в течение 12 месяцев после неоадъювантной или адъювантной ХТ. Как и пембролизумаб, он может быть применен в 1-й линии терапии у пациентов с высоким уровнем экспрессии PD‐L1, не подходящих для цисплатинсодержащей терапии.
Как отметил проф. Б. Я. Алексеев на одной из школ РООУ, схема, подразумевающая одновременное применение химиотерапии и атезолизумаба, зарегистрирована в МЗ РФ и в настоящее время проходит соответствующая работа по ее включению в отечественные рекомендации.
Поддерживающая терапия
В течение последних пяти десятилетий схема лечения метастатического и (или) нерезектабельного уротелиального рака оставалась неизменной, основанной на платиносодержащих схемах. «К сожалению, мы знаем, что достигаемые в 50–60 % объективные ответы при использовании подобных схем химиотерапии скоротечны, в первый год прогрессирование происходит у большинства больных, почти у 70 %», – отмечает А. К. Носов.
Учитывая отмеченные эффекты иммунотерапии, использованной сразу после завершения курса химиотерапии, научное сообщество пришло к выводу: чтобы начать лечение ингибиторами иммунных контрольных точек, ждать прогрессии не надо. Согласно обновленным рекомендациям, лечение должно быть назначено незамедлительно – после нивелирования токсических проявлений проведенной химиотерапии. Данная рекомендация обоснована результатами Javelin Bladder 100, объединившего 700 пациентов. После успешного завершения курса химиотерапии пациенты были рандомизированы в две группы – получающие авелумаб или просто надлежащий уход (best supportive care).
Общая выживаемость через 1 год составила 71,3 % в группе авелумаба и 58,4 % в контрольной группе (медиана общей выживаемости 21,4 месяца по сравнению с 14,3 месяца). Авелумаб также значительно продлил общую выживаемость в PD-L1-положительной популяции: общая выживаемость через 1 год составила 79,1 % в группе авелумаба и 60,4 % в контрольной группе.
«Это исследование – входной билет для применения авелумаба на более ранней стадии, как и в принципе для смещения иммунотерапии на более приоритетные позиции», – считает А. К. Носов.
Дело в том, что все ингибиторы иммунных контрольных точек показаны для применения во второй линии терапии (после прогрессирования) и в 1-й линии у пациентов с высокой экспрессией PD-L1, не подходящих для платиносодержащей терапии. Пембролизумаб также одобрен для лечения карциномы in situ, РМП, рефрактерного к бацилле Кальмета – Герена, а также для пациентов, не подходящих для радикальной цистэктомии или не желающих подвергнуться ей.
«Однако частота объективного ответа при назначении терапии ингибиторами иммунных контрольных точек в среднем колеблется от 20 до 23 %, что в два раза ниже, чем при химиотерапии с применением цисплатина, – отмечает А. К. Носов. – Но при этом пациенты, ответившие на применение иммунотерапии, имеют очень продолжительное сохранение достигнутого эффекта, много превышающее по длительности ответ после применения химиотерапии».
Таким образом, отмечает А. К. Носов, объединение двух лекарственных модальностей – это возможность максимально увеличить эффективность лечения у максимального количества пациентов. «До сегодняшнего дня химиотерапия демонстрирует максимальное число ответов, как частичных, так и полных, а иммунотерапия обеспечивает высокую продолжительность достигнутых эффектов, – подчеркивает А. К. Носов. – Объединение двух вариантов лечения – это удачная и однозначно востребованная идея, позволяющая достигнуть потенцирования двух лекарственных направлений: с одной стороны, мы достигаем наибольшего числа объективных ответов, а с другой – поддерживаем их максимально долго».
А. К. Носов отмечает, что комбинированный подход позволяет реализовать максимально эффективную первую линию терапии, что чрезвычайно важно, так как возможности назначения второй линии у большинства больных метастатическим уротелиальным раком нет.
Как отметил в текущем году на ASCO-GU ведущий мировой эксперт в области иммунотерапии T. Powles, абсолютное большинство пациентов просто не успевают получить вторую линию терапии в силу экстремально быстрой прогрессии заболевания и значительно ухудшающегося функционального статуса: «Когорта больных, получающих вторую линию терапии, истощается примерно втрое», – отметил он.
По мнению T. Powles, применение иммунотерапии в поддерживающем режиме, то есть сразу после завершения химиотерапии, позволит максимально расширить популяцию больных, которые смогут пройти эффективное лечение с сохранением достойного качества жизни.
На настоящий момент идея поддерживающей терапии ингибиторами иммунных контрольных точек при уротелиальном раке также реализуется для пациентов, перенесших цистэктомию. Так, в текущем году на ASCO-GU были продемонстрированы результаты применения ниволумаба в адъювантном режиме: медиана выживаемости без прогрессирования составила 21 месяц в группе пациентов, получавших ниволумаб, и 11 месяцев в группе плацебо.
«Мы также принимали участие в настоящем протоколе, и хотя эти результаты еще не отразились на рекомендациях и пока опубликованы лишь в качестве доклада на ASCO-GU, они являются еще одним аргументом в пользу как можно более раннего назначения ингибиторов иммунных контрольных точек при уротелиальном раке», – отметил А. К. Носов.
Без химии?
Учитывая новые данные, возможно ли предположить полное исчезновение химиотерапии из схем лечения уротелиального рака? А. К. Носов считает, что в ближайшее время обойтись без химиотерапии невозможно: «Первое, о чем думает врач, разрабатывая тактику лечения пациента с метастатическим или неоперабельным уротелиальным раком, – о возможности назначить химиотерапию; более того, мы должны стремиться провести терапию, основанную на цисплатине, – говорит эксперт. – И только пациенты, неспособные перенести химиотерапевтическое лечение, в первой линии получают лечение ингибиторами иммунных контрольных точек».
А. К. Носов подчеркивает, что, как и во всем мире, в России существует проблема недоиспользования химиотерапии и глобальный тренд в сторону предпочтения карбоплатины. «Зачастую применение карбоплатины обосновано не реальными показаниями, а желанием доктора оставаться в зоне комфорта», – считает А. К. Носов.
Интересно, что аналогичный тренд продемонстрирован в европейских и американских популяционных исследованиях: не менее одной трети пациентов, подходящих для применения химиотерапии на основе цисплатина, получают карбоплатин – достоверно менее эффективный режим.
В исследованиях реальной клинической практики США также выявлена выраженная диспропорция среди пациентов, требующих лечения и получающих его: недостаточное использование системной терапии в целом и непропорционально высокая частота применения химиотерапии на основе карбоплатина [3].
«В этом контексте надо максимально жестко добиться соблюдения протоколов лечения всех категорий больных уротелиальным раком и достичь такой ситуации, когда не менее половины пациентов будут получать цисплатин, то есть тот препарат, который демонстрирует наибольшую эффективность в отношении этой категории пациентов, – отмечает А. К. Носов. – Дополнение терапии цисплатином ингибиторами иммунных контрольных точек даст дополнительные преимущества. Но начать надо с того, чтобы пациенты просто могли получить химиотерапию, основанную на цисплатине».
Согласно Umang Swamo, стратегия увеличения доли пациентов, получающих системную терапию в первой и последующих линиях, предполагает:
- увеличение финансовой и логистической доступности системного лечения (affordability и accessibility);
- стандартизацию и улучшение качества помощи пациентам с локализованными формами РМП с целью улучшения сохранности их функционального статуса и возможности дальнейшего назначения системной терапии;
- отсрочку и снижение частоты прогрессирования локализованных форм уротелиального рака за счет улучшения использования неоадъювантной химиотерапии на основе цисплатина и разработки более эффективных схем неоадъювантной и (или) адъювантной терапии с применением новейших лекарственных средств;
- введение в реальную клиническую практику поддерживающей терапии с применением авелумаба после ответа или стабилизации заболевания на фоне 4–6 циклов химиотерапии на основе платины с целью минимизации отсева пациентов для получения терапии ингибиторами иммунных контрольных точек;
- внедрение в реальную клиническую практику эффективных и хорошо переносимых схем системной терапии, таких как комбинация энфортумаб ведотин с ингибиторами PD-1/L1 (или без них) в первой линии терапии.
Увеличение доступности в мировой литературе описывается двумя схожими по переводу, но абсолютно разными по значению словами – affordability и accessibility. Под affordability дословно понимается финансовая доступность лекарственных средств (cheap enough for ordinary people to afford), под accessibility – логистическая (easy for anyone to obtain and use).
«Нельзя не отметить, что, как бы мы ни ругали эти КСГ и прочие схемы, а все же доступность современного лечения в двух отмеченных аспектах увеличилась, – подчеркивает А. К. Носов. – Наравне с требованиями по доступности мы должны проявлять жесткие требования по соблюдению стандартов лечения и обеспечению пациентам сохранного статуса, позволяющего проводить системную терапию».
Бежать, чтобы оставаться на месте
«Обновленные рекомендации по сочетанию возможностей химиотерапии и иммунотерапии – это действительно новая парадигма терапии нерезектабельного или метастатического уротелиального рака. Но мы должны рассматривать ее не как будущее и даже не как настоящее в лечении пациентов с уротелиальным раком, – подчеркивает А. К. Носов. – Эти современные схемы должны максимально быстро становиться рутинными.
Эксперт подчеркивает, что современное поколение врачей стало свидетелем невероятно стремительного развития фармакологии: новые опции лечения устаревают быстрее, чем успеют стать рутинными. «Уже сейчас завершены исследования, продемонстрировавшие более высокую эффективность новых препаратов, в частности – энфортумаб ведотина, – отмечает А. К. Носов. – Однако чрезвычайно высокая стоимость делает современные лекарственные подходы недоступными для абсолютного числа национальных систем здравоохранения.
Как заявляется в мировой прессе, упомянутый препарат (энфортумаб ведотина) не входит в широкую практику исключительно из-за высокой стоимости. Так, согласно заявлению производителя, стоимость курса лечения им составит 110–120 тысяч долларов [5]. «Так или иначе, то, что сегодня считается новым и прорывным, в итоге устареет, – и мы должны стремиться к тому, чтобы новые и эффективные подходы использовались рутинно уже сейчас».
. . .
В статье упомянуты следующие данные:
- T. Powles et al., Avelumab Maintenance Therapy for Advanced or Metastatic Urothelial Carcinoma // NEJM, 2020.
- M.Galsky et al., Atezolizumab with or without chemotherapy in metastatic urothelial cancer (IMvigor130): a multicentre, randomised, placebo-controlled phase 3 trial // The Lancet, 2020.
- Richters, A., et al., Utilization of systemic treatment for metastatic bladder cancer in everyday practice: results of a nation-wide population-based cohort study. Cancer Treatment Res. Commun., 2020.
- Umang Swami et al., Utilization of systemic therapy for treatment of advanced urothelial carcinoma: Lessons from real world experience // Cancer treatment and research communication, 2021.
- https://www.bioworld.com/articles/431921-fda-grants-accelerated-approval-for-padcev-to-treat-urothelial-cancer.
. . .
Носов А К.
Ссылка на источник - Российское общество онкоурологов (РООУ).